高危/高肿瘤负荷mHSPC患者接受阿帕他胺治疗后,PSA水平快速、深度、持久降低,疗效显著且安全性好。JoK帝国网站管理系统
前列腺特异抗原(PSA):110.4 ng/ml。
CT盆腔+胸部+全腹平扫+增强(2016-09-13):盆腔未见肿大淋巴结,未见明确异常强化灶。但脊柱、肋骨及两侧髂骨多发成骨灶,需考虑转移可能。
全身骨显像(2016-09-14)(图1):右侧第5后肋,左侧第7、11后肋,第8、10胸椎,第4腰椎,左侧髂骨局部放射性异常浓聚,考虑转移可能性大。
 JoK帝国网站管理系统
JoK帝国网站管理系统
前列腺10点穿刺标本“14”点均见前列腺癌组织,Gleason评分为4+4=8分。
高危/高肿瘤负荷转移性激素敏感性前列腺癌(mHSPC),T4N0M1b。
2016年9月22日,患者开始服用阿帕他胺240mg QD治疗。2016年10月11日,患者开始注射醋酸戈舍瑞林。患者接受阿帕他胺+ADT(雄激素剥夺治疗)治疗2个月后,复查显示PSA从110.4 ng/ml快速降低到35.37 ng/ml,4个月后降低到0.02 ng/ml并持续维持(图2)。PSA呈现快速、深度降低。睾酮一直维持在0.57 nmol/l;且截止到2017年12月22日,全身骨显像显示浓聚减少灶(图3) 。
 JoK帝国网站管理系统
JoK帝国网站管理系统
图3 患者全身骨显像结果变化(2016.09-2019.07)
2019年10月,患者接受阿帕他胺治疗37个月后出现PSA进展(无影像学进展,无症状进展),患者继续维持阿帕他胺治疗。2020年9月,患者接受阿帕他胺治疗48个月后,因影像学进展,开始接受阿比特龙等后续治疗。
病例提供医生JoK帝国网站管理系统
-
-
-
中国抗癌协会泌尿男生殖系肿瘤精准医学学组委员兼秘书
-
擅长泌尿系肿瘤的微创治疗、前列腺增生各类激光剜除术,泌尿系结石的微创治疗。主攻方向为前列腺MRI/超声融合靶向精准穿刺,前列腺癌局灶HIFU治疗,机器人前列腺癌根治术及综合治疗
-
作为SUB-I负责多项国际及国内多中心,II/III 期药物临床试验
-
-
在国内外专业期刊发表18篇论文,其中SCI 4篇,参与专著1本
单用ADT治疗的mHSPC患者在一至两年内即进展为转移性去势抵抗性前列腺癌(mCRPC),中位总生存时间不足4年[1]。此外,以传统AR抑制剂为基础的联合雄激素阻断方案(传统CAB)获益有限[2],难以满足日益提高的患者治疗期望。
JoK帝国网站管理系统
随着循证研究和临床实践的支持,以阿帕他胺为代表的新型AR抑制剂联合ADT治疗成为了mHSPC治疗的新趋势——2020欧洲泌尿外科学会(EAU)指南强烈推荐阿帕他胺联合ADT用于首次表现为M1疾病且适用于该方案的患者[3]。2020美国国立综合癌症网络(NCCN)指南和美国泌尿外科学会(AUA)指南同样高级别推荐阿帕他胺作为mHSPC的治疗方案之一[4,5]。
另外,2021美国临床肿瘤学会泌尿生殖系统肿瘤研讨会(ASCO-GU)上TITAN研究最终分析公布,经过4年的随访,结果显示mHSPC患者接受阿帕他胺+ADT治疗的4年生存率可以达到65%左右,整体降低35%死亡风险;亚组分析进一步揭示阿帕他胺对所有类型mHSPC患者均可带来获益[6]。
本例患者属于高Gleason评分、多发骨转移的高危/高肿瘤负荷mHSPC,由于患者治疗意愿积极,确诊后即入组了新一代抗雄抑制剂阿帕他胺的临床III期研究,治疗后患者PSA水平实现快速、深度、持久降低,且PSA水平长期维持在0.02ng/ml,阿帕他胺+ADT治疗4年,患者影像学无进展,转移灶缩小,体现了显著疗效。
本案例患者确诊高危/高肿瘤负荷mHSPC时,年龄为62岁,年龄在晚期前列腺癌患者中属于“低龄”,患者的生存意愿及治疗意愿强烈,我们应该为患者努力地延缓疾病的进展,争取生存时间。传统CAB治疗获益有限,入组阿帕他胺临床试验对于当时的患者而言是一种较好的治疗选择。随后的临床实际疗效证实了这一点,患者接受阿帕他胺+ADT治疗后的37个月,PSA无进展,治疗4年,患者的影像学无进展,这体现了阿帕他胺为患者带来的显著疗效。
另外,PFS2可以体现研究用药对后续治疗的影响,完整反映研究药物对患者治疗全程的获益。虽然患者在接受阿帕他胺治疗48个月时,由于影像学进展,后续治疗换用为阿比特龙等药物,但TITAN研究的PFS2风险分层分析的结果显示,无论高危/高肿瘤负荷还是低危/低肿瘤负荷患者,一线使用阿帕他胺联合ADT治疗均能降低PFS2风险[7]。
专家简介JoK帝国网站管理系统
-
-
-
华东医院“国家药物临床研究机构-泌尿外科专业组 负责人
-
-
中国临床肿瘤学会(CSCO)前列腺癌专家委员会 委员
-
-
-
擅长泌尿男生殖系统肿瘤早期诊断与综合治疗,处于国内领先水平
JoK帝国网站管理系统
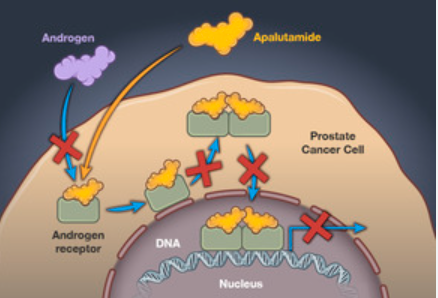
阿帕他胺作为一种新型AR抑制剂,抑制雄激素-AR结合的能力、阻止活化AR进入细胞核的能力、阻止AR与核内DNA结合的能力均强于传统AR抑制剂比卡鲁胺。在临床III期的关键研究TITAN中纳入了“All Comer”类型mHSPC人群,包括局限性前列腺癌复发转移患者、既往接受过全身/局部治疗的mHSPC患者、CHAARTED研究入组人群(高瘤负荷/低瘤负荷患者)以及LATITUDE研究入组人群(高危/低危mHSPC患者)等等,结果显示阿帕他胺具有显著的生存获益,并显示出快速、持久的PSA深度应答,且对于包括高危/高肿瘤负荷人群在内的所有类型患者均有显著获益[8],为mHSPC患者带来了高效且安全的治疗方案。
本案例中患者在确诊为高危/高肿瘤负荷mHSPC患者之后,幸运入组了阿帕胺临床试验,治疗2月后PSA水平迅速下降,长期维持在0.02ng/ml的较低水平,治疗4年期间影像学无进展。这与既往研究证实阿帕他胺具有更好更快的PSA应答率,也有更好的生存获益结果相一致。TITAN研究的最终结果奠定了阿帕他胺在mHSPC中的指南一线推荐地位,期待其得到早期规范化的临床应用,为患者争取长期的生存获益。
专家简介JoK帝国网站管理系统
-
上海交通大学医学院附属仁济医院泌尿科 JoK帝国网站管理系统
-
副主任医师,博士,副教授JoK帝国网站管理系统
-
中国医疗保健国际交流促进会泌尿健康促进分会青年委员会副主任委员JoK帝国网站管理系统
-
上海交通大学医学院附属仁济医院前列腺肿瘤诊疗中心主任(浦西)JoK帝国网站管理系统
-
擅长各种泌尿系肿瘤腹腔镜及开放手术,特别是腹腔镜下前列腺癌根治手术、保留性神经的前列腺癌根治手术,高危局部进展性前列腺癌的腹腔镜微创根治术及扩大淋巴结清扫术等高难度手术JoK帝国网站管理系统
-
主攻方向为前列腺肿瘤的早期诊断、微创手术治疗及晚期前列腺癌的个体化精准规范治疗JoK帝国网站管理系统
-
先后在国际英文SCI刊物以第一作者及通讯作者发表论文10余篇,国内核心期刊发表论文14篇JoK帝国网站管理系统
-
参与主编泌尿外科专著1部JoK帝国网站管理系统
参考文献:JoK帝国网站管理系统
[1] James ND, et al. Survival with Newly Diagnosed Metastatic Prostate Cancer in the "Docetaxel Era": Data from 917 Patients in the Control Arm of the STAMPEDE Trial (MRC PR08, CRUK/06/019)[J]. Eur Urol. 2015 Jun;67(6):1028-1038.
[2] Usami M, et al. Bicalutamide 80 mg combined with a luteinizing hormone-releasing hormone agonist (LHRH-A) versus LHRH-A monotherapy in advanced prostate cancer: findings from a phase III randomized, double-blind, multicenter trial in Japanese patients. Prostate Cancer and Prostatic Diseases 2007; 10: 194-201.
[3] Mottet N, et al. EAU/ESTRO/ESUR/SIOG Guidelines on Prostate Cancer 2020.
[4] James LM, et al. NCCN Clinical Practice Guideline in Prostate Cancer 2020 v1.
[5] Lowrance W, et al. AUA Guideline. American Urological Association 2020.
[6] Apalutamide (APA) for metastatic castration-sensitive prostate cancer (mCSPC) in TITAN:Outcomes in patients (pts) with low- and high-risk disease. Mustafa O, et al., 2020 ASCO GU. Abstract 87.
[7] Chi K N, Chowdhury S, Bjartell A et al. Final analysis results from TITAN: A phase III study of apalutamide (APA) versus placebo (PBO) in patients (pts) with metastatic castration-sensitive prostate cancer (mCSPC) receiving androgen deprivation therapy (ADT). Journal of Clinical Oncology 39, 2021 (Suppl 6; abstr 11).
[8] Chi K N, Agarwal N, Bjartell A, et al. Apalutamide for metastatic, castration-sensitive prostate cancer. New England Journal of Medicine 2019; 381:13-24.